Skillnad mellan Valency och Valence Electrons | Valens vs Valenceelektroner
Huvudskillnader - Valens vs Valenselektroner
Valenselektroner och valenselektroner är interrelaterade termer, och nyckelförskjutningen mellan valens och valenselektroner förklaras bäst i deras definitioner; valenselektroner är elektronerna i yttersta skalet hos ett element medan valenselektroner är antalet elektroner som bör accepteras eller avlägsnas för att uppnå närmaste ädelgaskonfiguration. Det är elektronerna i yttersta skalet som vanligtvis bidrar till att bilda kemiska bindningar. I vissa atomer är antalet valenselektroner lika med antalet valenselektroner.
Vad är Valence Electron? Antalet elektroner i det yttersta skalet hos en atom kallas "valenselektroner". På grund av denna anledning kallas det yttersta skalet av en atom "valensskal". För det mesta är dessa elektroner som deltar i kemisk bindning. När element bildar katjoner, tar de bort elektroner från valensskalet. Antalet valenselektroner i ett element bestämmer gruppen i det periodiska tabellen.

Antalet elektroner som krävs för att vinna eller förlora för att fylla det yttersta skalet hos en atom kallas "valenselektroner". För en viss atom beror antalet valenselektroner på antalet valenselektron i atomen. För Natrium är valensen lika med 1, eftersom den tar bort den sista elektronen i yttersta skalet för att uppnå oktetstruktur av närmaste ädelgas.
|
Definition av valens och valenselektroner
Valenselektroner:
Elektronerna i det yttersta skalet hos en atom kallas "valenselektroner". För "s" och "p" gruppelement är antalet valenselektroner lika med deras gruppnummer. Exempel
Valenselektroner:
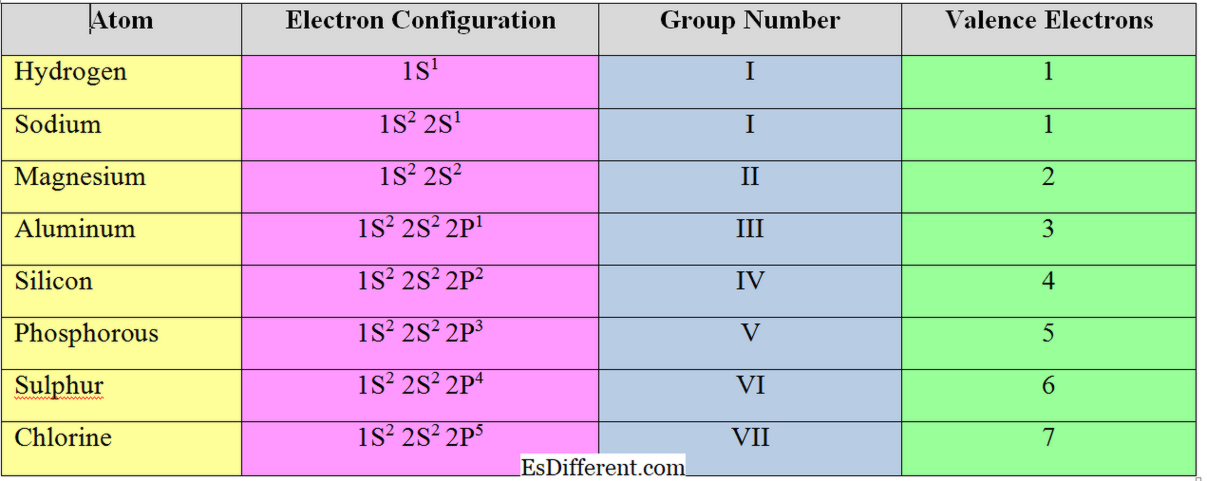
Antalet elektroner som ska accepteras eller avlägsnas för att uppnå elektronkonfigurationen för närmaste ädelgas kallas "valenselektroner" eller "valens" för en atom. I allmänhet är antalet valenselektroner för metallelement (element i grupp I, II och III) lika med antalet valenselektroner; de tar bort elektronerna i valensskalet för att uppnå oktettstrukturen.
Men icke-metallelement accepterar elektroner för att uppnå elektronkonfigurationen för närmaste ädelgas. Därför beräknas valensen av icke-metallelement genom att subtrahera de totala valenselektronerna från 8.
För klor, Antal valenselektroner = 8-7 = 1
Egenskaper hos Valens och Valenselektroner

Valens och Valenselektroner av grupp VIII-element
Valenselektroner:
Grupp VIII-element är de ädla gaserna, och de är kemiskt stabila. Deras yttre skal är fullständigt och det innehåller åtta elektroner i yttersta skalet (förutom Helium-He); så att grupp VIII elektroner har åtta valenselektroner. Valenselektroner:
Valens är ett mått på förmågan att bilda bindningar med andra element eller molekyler. Ädelgaser accepterar inte eller tar bort elektroner för att uppnå oktettregeln eftersom de redan har slutfört det sista skalet. Därför är valensen av grupp VII-element lika med noll. Image Courtesy:
"Elektronskal 010 Neon - ingen etikett" av commons: Användare: Pumbaa (originalarbete av commons: Användare: Greg Robson) - // commons. wikimedia. org / wiki / Kategori: Electron_shell_diagrams (motsvarande märkt version). (CC BY-SA 2. 0 uk) via Commons




