Skillnad mellan hydroxyl och hydroxid | Hydroxyl vs hydroxid
Huvudskillnad - Hydroxyl vs hydroxid
De två termen hydroxyl och hydroxid låter väldigt lika eftersom båda har två liknande atomer, syre (O = 16) och väte (H = 1). Hydroxid är en negativ jon med en enda laddning och hydroxyl finns inte i sin fria form, det är en del av en annan molekyl eller jon. Hydroxidjoner är mer reaktiva än hydroxylgruppen i en molekyl. Detta är nyckelfaktorn mellan hydroxyl och hydroxid.
Vad är hydroxyl?
Hydroxyl är en neutral förening och det är den motsvarande elektriskt neutrala föreningen av hydroxidjon. Den fria formen av hydroxyl (• HO) är en radikal och när den är kovalent bunden till andra molekyler betecknas den som hydroxyl (-OH) -gruppen. Hydroxylgrupper kan fungera som nukleofiler och hydroxylradikal används som katalysator i organisk kemi. Hydroxylgrupper är inte starkt reaktiva som de andra nukleofilerna. De är emellertid de som underlättar bildandet av starka intramolekylära krafter som kallas "vätebindningar".

Vad är hydroxid?
Hydroxid är en diatomisk anjon som innehåller en syreatom och en väteatom. Bindningen mellan syre och väteatom är kovalent och dess kemiska formel är OH - . Självjonering av vatten ger hydroxyljoner och därför är hydroxyljoner en naturlig del i vattnet. Hydroxidjoner användes som en bas, en ligand, en nukleofil och en katalysator i kemiska reaktioner. Dessutom alstrar vätejoner salter med metallkatjoner och de flesta av dem dissocierar i vattenhaltiga lösningar och frigör solvaterade hydroxidjoner. Många oorganiska kemiska ämnen innehåller termen "hydroxid" i deras namn, men de är inte joniska och de är kovalenta föreningar som innehåller hydroxylgrupper.

Vad är skillnaden mellan hydroxyl och hydroxid?
Struktur:
Hydroxyl: Hydroxyl är en elektriskt neutral förening som kan hittas på två sätt, såsom den radikala och den kovalent bundna formen.

Hydroxylradikal När den är kovalent bunden till en molekyl
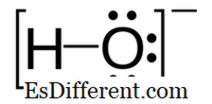
Hydroxid: Hydroxid är en negativt laddad jon och den negativa laddningen ligger på syreatomen.
Hydroxyl: Hydroxylgrupper finns i många organiska föreningar; alkoholer, karboxylsyror och hydroxylgrupper innehållande socker. Föreningar innehållande hydroxylgrupper såsom vatten, alkoholer och karboxylsyror kan lätt deprotoneras.Dessutom är dessa hydroxylgrupper involverade i bildandet av vätebindningar. Vätebindningar hjälper molekylerna att hålla ihop och detta leder till besittning av högre kokande och smältpunkter. I allmänhet är organiska föreningar dåligt vattenlösliga; dessa molekyler blir något vattenlösliga när de innehåller två eller flera hydroxylgrupper.
Hydroxid: De flesta kemikalier som innehåller hydroxid anses vara mycket frätande och vissa är mycket skadliga. När dessa kemikalier är upplösta i vatten fungerar hydroxidjonen som en oerhört stark bas. Eftersom hydroxidjon bär en negativ laddning bindas den ofta till positivt laddade joner.
Vissa joniska föreningar som innehåller hydroxidgrupper i deras molekyl upplöses riktigt bra i vatten; korrosiva baser såsom natriumhydroxid (NaOH) och kaliumhydroxid (KOH) kan tas som exempel. Vissa andra hydroxidhaltiga jonföreningar är emellertid något olösliga i vatten; Exempel är koppar (II) hydroxid [Cu (OH) 2 - ljusblå färgad) och järn (II) hydroxid [Fe (OH) 2 - brun].
Reaktivitet:
Hydroxyl : Hydroxylgrupper är mindre reaktiva jämfört med hydroxidgruppen. Men hydroxylgrupper bildar lätt vätebindningar och bidrar till att göra molekyler mer lösliga i vatten.
Hydroxylradikaler är emellertid mycket reaktiva och mycket användbara vid organiska kemiska reaktioner.
Hydroxid: Hydroxid (OH - ) gruppen betraktas som en stark nukleofil i organisk kemi.
Referenser: Martin. chaplin @ btinternet. com, M.C. (n. d.). Hydroxidjoner. Hämtad den 28 december 2016, härifrånHydroxidjon: Definition & Formel - Video & Lektionstranscript. (n. d.). Hämtad 28 december 2016, härifrån hydroxid. (n. d.). Hämtad 28 december 2016, härifrånHydroxigrupp. (n. d.). Hämtad 28 december 2016, häriHydroxylgrupp: Definition, struktur och formel. (n. d.). Hämtad 28 december 2016, härifrån H. (2014). Vad är en hydroxylgrupp? Hämtad 28 december 2016, härifrån



