Skillnad mellan etanol och etansyra | Etanol vs etansyra
Viktig skillnad - Etanol vs etansyra
Även om etanol och etansyra har liknande namn kan en nyckelskillnad observeras mellan dem eftersom de är två olika organiska föreningar som innehåller två olika funktionella grupper. Etanol är näst enklaste medlem i alkoholfamiljen medan etansyra är den näst enklaste medlemmen av karboxylsyragruppen. De innehåller bara två kolatomer utöver den funktionella gruppen som finns i molekylen. När vi jämför sina kemiska egenskaper båda används som organiska lösningsmedel och har en karakteristisk lukt. I motsats till detta är etansyra surare än etanol.
Vad är Etanol ?
Det vanliga namnet etanol är etylalkohol . Dess funktionella grupp är en hydroxylgrupp (-OH-grupp). Alla kemiska egenskaper som reaktivitet, surhet eller basicitet beror på funktionell grupp. Etanol har en mycket mild lukt, och det är en flyktig förening. Etanol är mycket viktigt i dess industriella tillämpningar; Det är ett säkert lösningsmedel, en bränslekälla, som används för att producera läkemedel och kosmetika och det är huvudkomponenten i alkoholhaltiga drycker. Etanol kan produceras inhemskt med hjälp av jordbruksavfall som majs, sockerrör eller gräs.

Vad är etansyra syra ?
Det vanligaste namnet för etansyra är ättiksyra . Det är en färglös vätska med en karaktäristisk sur smak och skarp lukt. Den har molekylformeln av CH 3 COOH. Den outspädda formen av etansyran kallas "isättika" och ungefär 3-9% syra i volym används för att göra ättika. Etansyra anses vara en svag syra; men det är frätande och kan attackera huden.
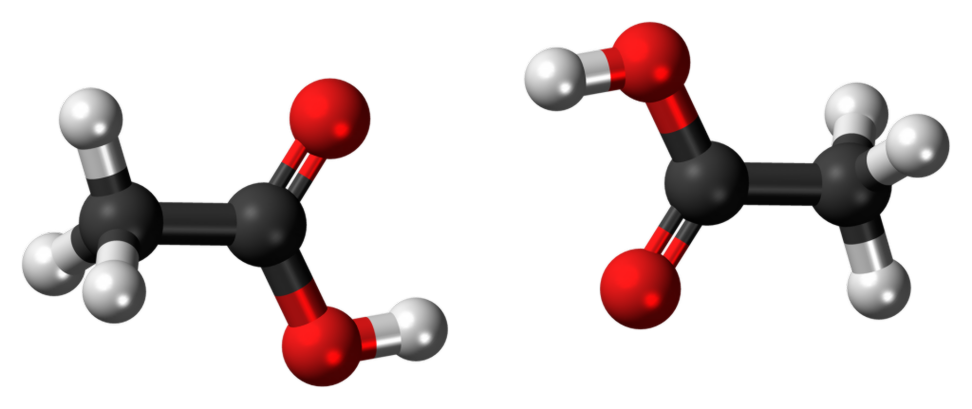
Vad är skillnaden mellan etanol och etansyra?
Egenskaper för etanol och etansyra:
Funktionsgrupp:
Etanol: Hydroxylgrupp (-OH-grupp) är funktionell grupp i etanol. Det är den karakteristiska egenskapen hos alkoholer. Alla alkoholer har minst en -OH-grupp i sin struktur.
Etansyra: Funktionsgruppen i etansyra är en -COOH-grupp. Det är vanligt för alla karboxylsyror.
Egenskaper:
Etanol: Etanol är en envärd alkohol med en söt lukt som kokar vid 78,5 ° C. Det är det enda kolväte som löses i vatten i alla proportioner.Etanol reagerar med alkalisk KMnO4 för att ge etansyra medan etansyra inte reagerar med alkalisk KMnO4.
Etansyra: Det är en svag monoprotisk syra i vattenlösning (pKa = 4, 76). Flytande ättiksyra är ett polärt lösningsmedel som vatten. Det löser upp både polära vätskor, såsom sockerarter och salter, och icke-polära vätskor, såsom oljor och element som svavel och jod. Det är lätt och fullständigt blandbart med vattenkloroform och hexan. Ättiksyra har en stark skarp lukt.
Användningar:
Etanol: Etanol är närvarande i alkoholhaltiga drycker och används även som biobränsle för bilar. Det är ett bra lösningsmedel som kan lösa upp många organiska lösningar som är olösliga i vatten. Etanol används för att tillverka många parfymer, kosmetika och lacker i färgindustrin.
Etanol som bränsle:
CH 3 CH 2 OH + 3O 2 → 2CO 2 + 3H 2 O Etansyra:
ättiksyra används som ett kemiskt reagens för att producera andra kemikalier. Den används i större kvantiteter för att producera vinylacetatmonomer; vinylacetat kan polymeriseras för framställning av polyvinylklorid eller andra polymerer. Dessutom används ättiksyra för att framställa estrar som används i bläck, målningar och beläggningar. Ättiksyraanhydrid är en annan viktig kemisk förening som kan syntetiseras genom kondensering av två molekyler ättiksyra. En liten mängd etansyra används för att producera hushållsäte. Surhet:
Etanol:
Etanol reagerar inte med natriumbikarbonat (NaHCO3) eller ändrar färgen på ett blått litmuspapper. Därför är det mindre surt än etansyra. Etansyra:
Etansyra är en svag syra som reagerar med natriumbikarbonat (NaHCO3) som frigör CO2-gas. Det blir också blått litmus till rött. Image Courtesy: "Etanol-3D-bollar". (Public Domain) via Wikimedia Commons "Ättiksyra dimer 3D-boll" av Jynto (talk) - eget arbete. (CC0) via Wikimedia Commons



