Skillnad mellan D-blockelement och övergångselement | D-blockelement vs övergångselementer
Huvudskillnad - D-blockelement vs övergångselementer
Skillnaden mellan D-blockelement och övergång element är ganska förvirrande. Båda orden används utbytbart, och många använder ordet "övergångselement" för d-block-element. nyckelförskjutningen mellan D-blockelement och övergångselement är att medan alla övergångselement är D-blockelement , är inte alla D-blockelement övergångselementer . Det är uppenbart att d-blockelement har d-elektroner i d-sub-skalet. Övergångselement är de element som bildar stabila joner som har ofullständigt fyllda d -orbitaler. Zink och Scandium är till exempel d-block-element; men inte övergångselement.
Vad är D-block-element?

D-blockelementen kan tydligt identifieras med elektronkonfigurationen och det periodiska bordets position. Huvuddragen hos d-blockelementet har åtminstone en elektron i delskalan d-. Den udda sak händer när fyllningen av elektroner enligt Aufbau -principen i d-blockelementen är 4s -elektronerna fylls först före 3d -elektronerna; vilket betyder att 3d-elktroner har högre energi än 4s-elektroner. Men när de tar bort elektroner för att bilda joner 4s -elektronerna avlägsnas först från atomen.
| Element | Elektronkonfiguration | |
| Scandium | Sc | [Ar] 3d 1 4s 2 |
| Titan | Ti | [Ar] 3d 2 4s 2 |
| Vanadin | V | [Ar] 3d 3 4s 2 |
| Krom | Cr | [Ar] 3d 5 4s 1 |
| Mangan | Mn | [Ar] 3d 5 4s 2 |
| Ferrous | Fe | [Ar] 3d 6 4s 2 |
| Kobolt | Co | [Ar] 3d 7 4s 2 |
| Nickel | Ni | [Ar] 3d 8 4s 2 |
| Koppar | Cu | [Ar] 3d 10 4s 1 |
| Zink | Zn | [Ar] 3d 10 4s 2 |
Obs: [Ar] = 1s 2 2s 2 2p 6 3s 2 3p 6
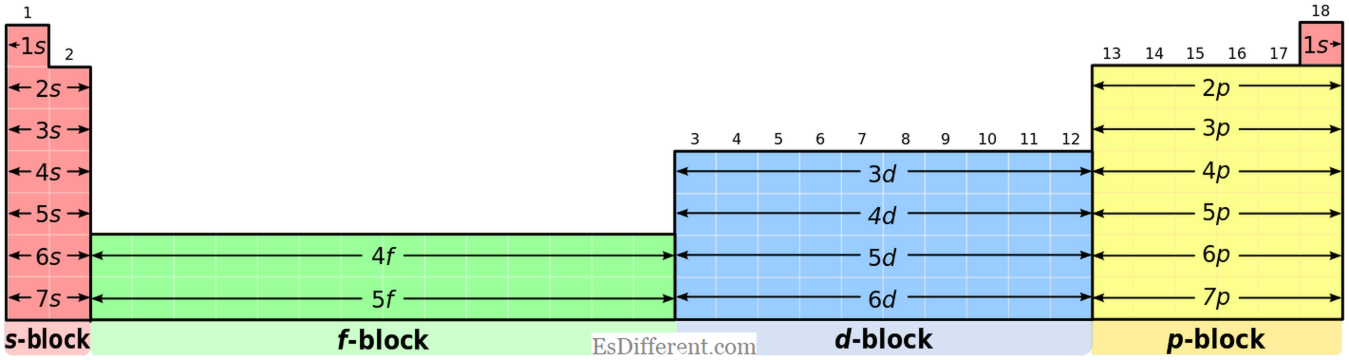
Vad är övergångselement?
Övergångselement är de element som bildar stabila joner med ofullständigt fyllda d-orbitaler. När joner bildas av d-blockelement De eliminerar först s -elektronerna (n-nivå) och tar sedan bort d -elektroner (n-1-nivå). Zink och Scandium är två specialelement i d-blocket; de bildar inte joner som har ofullständigt fyllt d -orbitaler; därför betraktas de inte som övergångselement.Alla övriga delar i d-gruppen bildar stabila joner som har ofullständigt fyllt d -elektroner.

Övergångsmetalllösningar
Vad är skillnaden mellan D-block-element och övergångselement?
De element som har en eller flera
d- elektroner i delskalan d- är kända som d-blockelement. De flesta d-blockelementen är metaller. Övergångselement: De element som kan bilda stabila joner med ofullständigt fyllda
d -orbitaler kallas övergångselement. Obs: Zn och Sc är inte övergångselement. De bildar inte bara Zn
2+
och Sc 3+ joner, som inte innehåller ofyllda d-orbitaler. Zn 2+
= 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 Sc 3+
= 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 Följande joner innehåller ofyllda d-orbitaler. Därför betraktas dessa element som övergångselement. Cu
2+
= 1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 2 4
= 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 Mn 2+
= 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 Fe 2+
= 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 Oxideringsstater: D-blockelement:
Vissa av D-blockelementen uppvisar flera oxidationstillstånd och få av dem visar ett enda oxidationstillstånd.
Exempel: Endast zink visar +2 oxidationstillstånd och Scandium visar endast +3 oxidationstillstånd.
Andra element i d-blocket visar flera oxidationstillstånd.
Övergångselement:
Övergångselement visar flera oxidationstillstånd. Åtminstone ett tillstånd innehåller ofyllda
d -orbitaler. Exempel: Titan +2, +4
Vanadin +2, +3, +4, +5
Krom +2, +3, +6
Mangan +2, +3, +4, +6, +7
Ferro +2, +3
Kobolt +2, +3
Nickel +2, +4
Koppar +1, +2
Bild Courtesy:
1. "Periodiska tabellblock spdf (32 kolumn)" av Användare: DePiep [CC BY-SA 3. 0] via Commons
2. "Colored-transition-metal-solutions" [Public Domain] via Commons


