Skillnaden mellan Alkanes och Alkene | Alkaner vs Alken
Huvudskillnad - Alkaner vs Alkenes
Alkaner och alkener är två typer av kolvätefamiljer som innehåller kol och väte i sin molekylstruktur. Nyckelfaktorn mellan alkaner och alkener är deras kemiska struktur; alkaner är mättade kolväten med den allmänna molekylformeln av C n H 2n + 2 och alkener sägs vara en omättad kolvätegrupp eftersom de innehåller en dubbelbindning mellan två kol atomer. De har den allmänna molekylformeln av C n H 2n.
Vad är Alkanes?
Alkaner innehåller endast enbindningar mellan kol- och väteatomer (C-C bindningar och C-H bindningar). Därför kallas de för "mättade kolväten". Enligt orbital hybridiseringsmodellen har alla kolatomer i Alkenes SP 3 hybridiseringen. De bildar sigmabindningar med väteatomer, och den resulterande molekylen har geometrin hos en tetraeder. Alkaner kan delas upp i två grupper enligt deras molekylära arrangemang; acykliska alkaner (C n H 2n. +2 ) och cykliska alkaner (C n H 2n ).

"Olefins"
är det gamla namnet som används för att referera till alkenfamiljen. Den minsta medlemmen i denna familj är etan (C 2 H 4 ); det kallades olefian t gas (på latin: ' oleum' betyder "olja" + "facere" betyder "att göra") i tidiga dagar. Detta beror på att reaktionen mellan C 2 H 4 och klor ger C 2 H 2 Cl 2 , olja.

Alkaner har den allmänna molekylformeln C
n
H 2n + 2. Metan (CH 4 ) är den minsta alkanen. - diff Artikel Middle before Table -> Namn Kemisk formel Acyklisk struktur
Metan| CH | 4 | CH 4 |
| Etan C | 2 H | 6 CH |
| 3 | CH 3 Propan C | 3 H 8 CH |
| 3 | CH 2 CH 3 | Butan C 4 H 10 CH 3 |
| CH | 2 CH 2 CH | 3 Pentan C 5 H 12 CH 3 |
| CH | 2 CH 2 CH | 2 CH 3 hexan C 6 H 14 CH 3 CH |
| 2 | CH 2 CH 2 | CH 2 CH 3 Heptan C 7 H 16 CH 3 CH |
| 2 | CH 2 CH 2 CH | 2 CH 2 CH 3 Octane C 8 H 18 CH 3 CH 3 |
| CH | 2 CH 2 CH | 2 CH 2 CH 3 CH 3 Alkener: Alkener har den allmänna kemiska formeln av C n H 2n .Alkener anses vara omättade kolväten eftersom de inte innehåller det maximala antalet väteatomer som kan ägas av en kolväte-molekyl. Namn Kemisk formel Struktur Eten |
C 2 H 4 CH 2 = CH 2
| Propen | C | 3 |
| H | 6 CH 3 CH = CH 2 Buten | C 4 H 8 |
| CH 2 = | CHCH 2 CH 3, CH 3 | CH = CHCH 3 Penten C 5 |
| H | 10 CH 2 = CHCH | 2 CH 2 CH 3, CH 3 CH = CHCH 2 CH 3 |
| Hexene | C 6 H 12 CH | 2 = CHCH 2 CH 2 CH 2 CH 3 CH 3 CH = CHCH 2 CH |
| 2 | CH 3 CH 3 | CH 2 CH = CHCH 2 CH 3 hepten C 7 H 14 CH = CHCH < 2 CH 2
CH 2 CH 2 CH 3 CH 3 CH = CH < 2 CH |
| 2 | CH 2 CH 2 | CH 3 Kemiska egenskaper hos alkaner och alkener Alkaner: Reaktivitet: Alkaner är inerta mot många kemiska reagens. Detta beror på att kol-kol (C-C) och kolväte (C-H) bindningar är ganska starka eftersom kol- och väteatomer har nästan samma elektronegativitetsvärden. Därför är det mycket svårt att bryta sina bindningar, såvida de inte värms till ganska höga temperaturer. Förbränning: Alkaner kan lätt brinna i luften. Reaktionen mellan alkaner med överskott av syre kallas förbränning. I denna reaktion omvandlas alkaner till koldioxid (CO 2 ) och vatten. C n H 2n + (n + n / 2) O 2 → CO 2 + nH 2 O C 4 H |
10
+ 13/2 O 2
→ 4 CO
2
+ 5H 2
O Butansyra Koldioxid Vatten Förbränningsreaktionerna är exoterma reaktioner (de ger upphov till värme). Som ett resultat används alkaner som en energikälla.
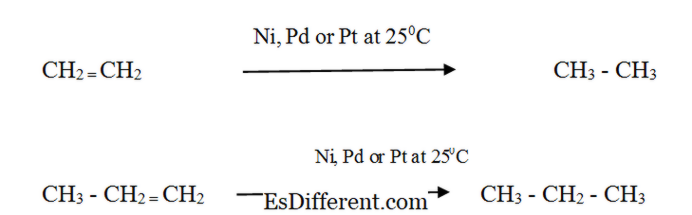
Alkener: Reaktivitet: Alkener reagerar med väte i närvaro av en finfördelad metallkatalysator för att bilda motsvarande alkan. Reaktionshastigheten är mycket låg utan katalysator. Katalytisk hydrogenering används i livsmedelsindustrin för att omvandla flytande vegetabiliska oljor till halvfast fett för att göra margarin och fast matlagningsfett. Alkanes och alkens fysikaliska egenskaper Former Alkaner: Alkaner finns som gaser, vätskor och fasta ämnen. Metan, etan, propan och butan är gaser vid rumstemperatur. De oförgrenade strukturerna av hexan, pentan och heptan är vätskor. Alkaner som har en högre molekylvikt är fasta ämnen. CH 4 till C
4 H 10 är gaser C 5 H 12 till C 17 H
36
är vätskor och
Alkaner med högre molekylvikt är mjuka fastämnen
Alkener:
Alkener visar liknande fysikaliska egenskaper hos motsvarande alkan. Alkener som har lägre molekylvikter (C
2
H
4
till C 4
H 8 ) är gaser vid rumstemperatur och atmosfärstryck.Alkener med högre molekylvikt är fasta ämnen. Löslighet: Alkaner: Alkaner löses inte upp i vatten. De löses i icke-polära eller svagt polära organiska lösningsmedel. Alkener:
Alkener är relativt polära molekyler på grund av C = C-bindningen; Därför är de lösliga i icke-polära lösningsmedel eller lösningsmedel med låg polaritet. Vatten är en polär molekyl och alkener är något lösliga i vatten. Densitet: Alkaner: Alkanes densiteter är lägre än vattentätheten. Deras densitetsvärde är nästan 0,7 g ml -1 med tanke på densiteten av vatten som 1. 0 g ml -1 . Alkenes:
Alkenes densiteter är lägre än vattendensiteten.
Kokpunkter: Alkaner: Kokpunkten för oförgrenade alkaner ökar smidigt, eftersom antalet kolatomer och molekylvikten ökar. I allmänhet har grenade alkaner lägre kokpunkter jämfört med de oförgrenade alkanerna, som har samma antal kolatomer. Alkenes : Kokpunkter motsvarar motsvarande alkaner med liten variation. Referenser: CliffsNotes. (n. d.). Hämtad 06 juli 2016, härifrån. Alkanes fysikaliska egenskaper. (2013). Hämtad den 6 juli 2016, härifrån Zum Directory-modus. (n. d.). Hämtad 06 juli 2016, härifrån Alkanes kemiska egenskaper: Wizznotes. com-Free GCSE och CXC: Tutorials, Past Papers och Quizzes. (n. d.). Hämtad 06 juli 2016, härifrån
Polaritet. (n. d.). Hämtad 06 juli 2016, härifrån
Dipole stunder. (2013). Hämtat 06 juli 2016, härifrån Strukturisk isomer. (n. d.). Hämtad 06 juli 2016, härifrån
En introduktion till alkener. (n. d.). Hämtad den 6 juli 2016, härifrån Image Courtesy:
"Alkene namn" Av Chris Evans - (CC0) via Commons Wikimedia
Bollpulver med mättad C4-kolväte "Av Fvasconcellos - Egent arbete Public Domain) via Commons Wikimedia



