Skillnad mellan syra-bas titrering och redox titrering | Acid-Base Titration vs Redox Titration
Huvudskillnad - surbasbasering mot redoxtitration
titreringar används för att bestämma koncentrationen av en okänd lösning (analyt). De vanligaste två titrimetriska metoderna är syra-bastitreringar och redoxtitreringar. nyckelförskjutningen mellan syra-bastitreringar och redoxtitreringar är typen av reaktionen som händer mellan titranten och analyten vid titreringen. Vid syrabastitreringar sker en neutraliseringsreaktion och vid redoxtitreringar sker en redoxreaktion (en oxidationsreaktion och en reduktionsreaktion). Användningen av indikatorer är den vanligaste metoden för bestämning av reaktionens slutpunkt.
Vad är en sur-bastitrering?
Vid syrabastitreringar används en syra (sura titreringar) eller en bas (basiska titreringar) som titreringsmedel. Exempel på syror som används vid sura titreringar är H 2 SO 4 , HCl eller HNO 3. Mest använda basiska titranter är NaOH, K 2 CO 3 eller Na 2 CO 3. Syrabastitreringar kan klassificeras enligt följande beroende på styrkan hos syran och basen.
- Stark syra - starka bastitreringar
- Starka svaga bastitreringar
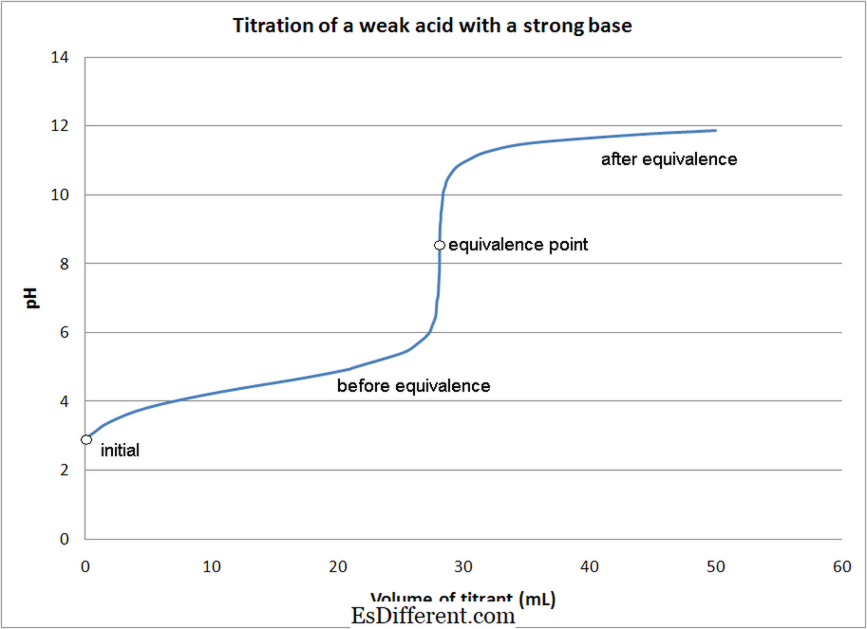
- Svag syra - starka bastitreringar
- Svag syra - svaga bastitreringar
I de flesta syrorna -bas titreringar, används indikatorer för att bestämma slutpunkten för reaktionen. Olika indikatorer används beroende på titreringstypen som nämnts ovan.
Vad är en Redox Titration?
En redoxtitrering innebär en redoxreaktion. Redox-reaktion har två reaktioner; en oxidationsreaktion och en reduktionsreaktion. Både oxidations- och reduktionsprocesser äger rum samtidigt som vi tillåter bestämning av slutförandet av reaktionen. Detta kallas också titreringens slutpunkt. Detta kan bestämmas på flera sätt; med hjälp av indikatorelektroder, redoxindikatorer (indikatorn ger en annan färg vid oxidationsreduktionstillstånd), och icke-redoxindikatorer (indikator ger en färg när ett överskott av titrant tillsätts).

Vad är skillnaden mellan sur-bastitrering och redoxtitrering?
Reaktionsens art:
Syra-bastitrering: En syrabastitrering involverar en neutraliseringsreaktion mellan analyten (lösningen med okänd koncentration) och den sura eller basiska titranten.
Redoxtitration: En redoxreaktion involverar en oxidations- och reduktionsreaktion mellan analyten och titranten. Det finns ingen sådan regel att komponenten oxiderar och vilken som minskar. Antingen analyt eller titranten oxiderar, och den återstående komponenten reduceras i enlighet därmed.
Bestämning av slutpunkten:
Acid-Base Titration: Generellt används en pH-indikator, en pH-mätare eller en konduktivitetsmätare för att bestämma slutpunkten för en syrabasititrering.
Redoxtitration: De vanligaste metoderna för att bestämma slutpunkten för en redoxreaktion använder en potentiometer eller en redoxindikator. Men oftast ger analten eller titranten en färg vid ändpunkten. Därför behövs inga ytterligare indikatorer i dessa fall.
Exempel:
Acid-Base Titration:
- diff Artikeln före tabell ->| Typ | Reaktion (Indikator) |
| Stark syra - stark bas titrering | HCl + NaOHàNaCl + H 2 O (fenolftalein / metyl orange) |
| Stark syra - svag bastitrering | HCl + NH 3 à NH 3 Cl (metylorange) |
| Svag syra - stark bastitrering | CH 3 COOH + NaOHa CH 3 COONa + H 2 O (fenolftalein) Svag syra-vävbas titrering |
| CH 3 | COOH + NH 3 ACH 3 COO - + NH 4 + Redoxtitrering: 2 KMnO 4 |
+ 5 H
2 C 2 O 4 + 6 HCl → 2 MnCl 2 + 2KCl + 10 CO 2 + 8 H 2 O (+7) (+3) (+2) 4) I ovanstående reaktion reduceras permanganat medan oxalsyra oxideras. När reaktionen fullbordas, förändras den lila färgen av permanganat i färglös. KMnO 4
+9FeCl
2
+ 8HCl → 5FeCl 3 + MnCl 2 + KCl + 4H 2 O (+7) (+2) (+3) (+2) Image Courtesy: 1. Titrering av svag syra med stark bas Genom Quantumkinetics (eget arbete) [CC BY 3. 0], via Wikimedia Commons 2. "Winkler Titration Prior Titration" av Willwood [CC BY-SA 3. 0] via Commons


