Skillnad mellan S och P blockelement | S vs P Block Elements
Huvudskillnad - S vs P Block Elements
Tangentskillnaden mellan s och p blockelement kan bäst förklaras med hjälp av sin elektroniska konfiguration. I s-blockelementen fyller den sista elektronen till s-delskalet och i p-blockelement fyller den sista elektronen till p-delskalan. När de bildar joner s blockelement avlägsnar sina elektroner från yttersta delskalan enkelt, medan p blockelement accepterar elektroner på p-skåpet eller tar bort elektroner från p-subshell. Vissa element i p-gruppen bildar positiva joner som tar bort elektroner från den yttersta p-delskalan och vissa element (de mest elektronegativa elementen) bildar negativa joner som accepterar en elektron från andra. När man överväger de kemiska egenskaperna finns det en signifikant skillnad mellan s och p blockelement; detta beror i grunden på elektronkonfigurationen.
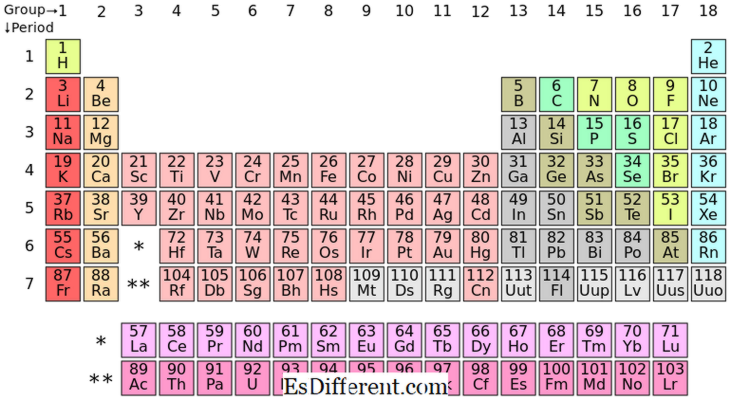
Vad är S-block-element?S-blockelement är de kemiska elementen i grupp I och grupp II i det periodiska tabellen. Eftersom s subshell kan rymma endast två elektroner, har dessa element vanligtvis en (grupp I) eller två (grupp II) elektroner i yttersta skalet. Elementen i grupp I och II visas ovan i tabellen.
- diff Artikel Artikel före tabell ->
IA| II A | 2 | |
| Li | Be | 3 |
| Na | Mg | 4 |
| K | Ca | 5 |
| Rb | Sr | 6 |
| Cs | Ba | 7 |
| Fr | Ra | - 9 -> |
IA
| Alkalimetaller | II A |
| Alkaljordiska metaller | Alla element i s-block bildar positiva joner och de är mycket reaktiva. |
Placeringen av S-blockelementen i det periodiska tabellen
P-blockelement är de element vars sista elektron fylls i p subshell. Det finns tre p-orbitaler; Varje omlopp kan rymma två elektroner, vilket gör totalt sex p-elektroner. Därför har p-blockelementen en till sex p-elektroner i deras yttersta skal. P-block innehåller både metaller och icke-metaller; dessutom finns det några metalloider också.
13
| 14 | 15 | 16 | 17 | 18 | 2 | |
| B | C | N | O | F Ne | 3 | Al |
| Si | P | S | Cl | Ar | 4 | Ga |
| Ge | Som | Se | Br | Kr | 5 | I |
| Sn | Sb | Te | I | Xe | 6 | Tl |
| Pb Bi | Po | Vid | Rn | Vad är skillnaden mellan S och P blockelement? | Gemensam elektronkonfiguration: | S-blockelement: |
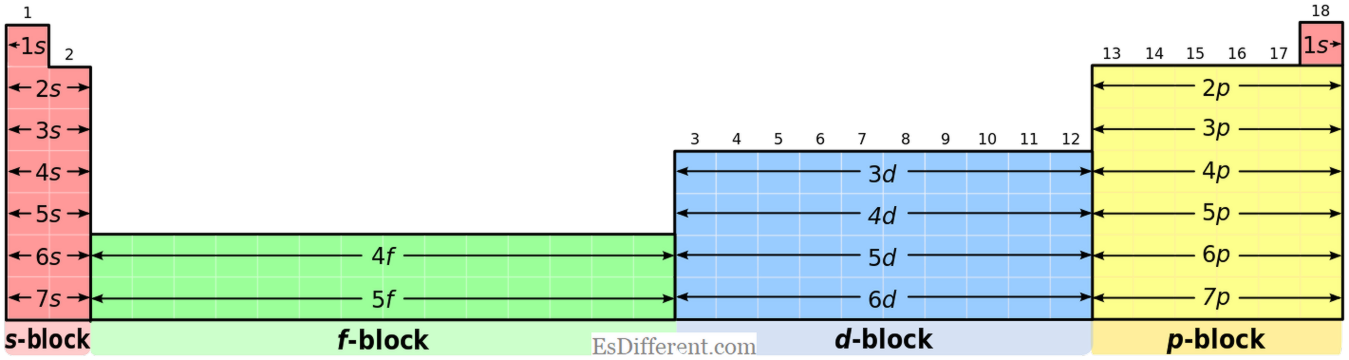
S-blockelement har den gemensamma elektronkonfigurationen av [ädelgas] ns
1
(för grupp I-element) och [ädelgas] ns 2 (för grupp II-element). P-blockelement: P-blockelement har den gemensamma elektronkonfigurationen av [ädelgas] ns 2
np 1-6 . Men helium har 1s 2 konfiguration; Det är en speciell situation. Oxidationsstater: S-blockelement: S-blockelementen visar inte flera oxidationstillstånd som p-blockelement. Exempelvis visar grupp I-elementen +1 oxidationstillstånd och grupp II-element visar +2 oxidationstillstånd.
P-blockelement:
Till skillnad från s-blockelementen har p-blockelementen ett gemensamt oxidationstillstånd för respektive grupp i det periodiska systemet och några andra ytterligare oxidationstillstånd beroende på jonens stabilitet. Grupp
13 14
| 15 | 16 | 17 | 18 | Generell elektronkonfiguration | ns | 2 |
| np | 1 ns 2 np | 2 ns 2 np | 3 ns 2 np | 4 ns 2 np 5 | ns 2 np 6 | 1 st medlem av gruppen Var < C |
| N O F | He | Vanligt oxidationsnummer | +3 | +4 | +5 | -2 |
| -1 | 0 | Övriga oxidationstillstånd | +1 | +2, -4 | +3, -3 | +4, +2, |
| +3, +5, + 1, +7 | - | Egenskaper: | S-blockelement: | Allmänt är alla s-blockelementen metaller. De är glänsande, bra elektriska och värmeledare och lätt att ta bort elektroner från valensskal. De är de mest reaktiva elementen i det periodiska bordet. | P-blockelement: | De flesta av p-blockelementen är icke-metaller. De har låga kokpunkter, dåliga ledare och svåra att ta bort elektroner från yttersta skalet. I stället får de elektroner. Några av de icke-metallerna är fastämnen (C, P, S, Se) vid rumstemperatur medan vissa är gaser (syre, kväve). Brom är en icke-metall, och det är en vätska vid rumstemperatur. |
Dessutom innehåller p-blocket några metallelement; aluminium (Al), gallium (Ga), indium (In), tenn (Sn), tallium (Tl), bly (Pb) och vismut (Bi).
Image Courtesy: 1. "Periodiskt bord (polyatomiskt)" av DePiep [CC BY-SA 3. 0] via Commons
2. "Periodisk tabellblock spdf (32 kolumn)" av Användare: DePiep [CC BY-SA 3. 0] via Commons


