Skillnad mellan normal hemoglobin och sylcellhemoglobin | Normal Hemoglobin vs Sickle Cell Hemoglobin
Huvudskillnad - Normal Hemoglobin vs Sicklecell Hemoglobin
Hemoglobin (Hgb) är huvudproteinmolekylen som ger Den röda blodcellens typiska form - rund form med ett smalt centrum. Hemoglobinmolekylen består av fyra subproteinmolekyler, i vilka två kedjor är alfa-globulinkedjor, och de andra två är beta-globulinkedjor. Järnatomer i hemoglobin och formen av de röda blodkropparna är viktiga för syretransport via blod. Om formen av hemoglobin förstörs misslyckas det att transportera syre genom blodet. Sicklecellshemoglobin är en typ av en onormal hemoglobinmolekyl som orsakar anemi-tillstånd som kallas sicklecellanemi. Den viktigaste skillnaden mellan normalt hemoglobin och sicklecellhemoglobin är att normalt hemoglobin har glutaminsyra i positionen 6 th av aminosyrasekvensen i beta-globulinkedjan medan sicklecell hemoglobin har Valine i positionen 6 th av beta-globulinkedjan. Normalt hemoglobin och sicklecellhemoglobin skiljer sig endast av en enda aminosyra i beta-kedjor.
INNEHÅLL
1. Översikt och nyckelfaktor
2. Vad är normalt hemoglobin
3. Vad är Sickle Cell Hemoglobin
4. Jämförelse vid sida vid sida - Normal Hemoglobin vs Sickle Cell Hemoglobin
5. Sammanfattning
Vad är normalt hemoglobin?
Hemoglobin är ett järnhaltigt metalloprotein som finns i röda blodkroppar. Det är ansvarigt för transport av syre från lungan till kroppens vävnader och organ, och transport av koldioxid från kroppsvävnad till lungan. Det är också känt som syrgasbärande protein i blodet. Det är ett komplext protein, som består av fyra små proteinunderenheter och fyra hemgrupper som bär järnatomer som visas i figur 01. Hemoglobin har en hög affinitet för syre. Det finns fyra syrebindningsställen placerade inuti en hemoglobinmolekyl. När hemoglobin mättas med syre blir blodet rött i färg och är känt som syrgas. Det andra tillståndet av hemoglobinet, som saknar syre, är känt som deoxihemoglobin. I detta tillstånd bär blod i mörkröd färg.
Järnatomer som är inbäddade i hemoglobins hemeförening underlättar främst syre- och koldioxidtransporten.Bindning av syremolekyler till Fe +2 joner förändrar hemoglobinmolekylens konformation. Järnatomerna i hemoglobinet bidrar också till att upprätthålla den typiska formen hos den röda blodkroppen. Därför är järn ett viktigt element som finns i de röda blodkropparna.
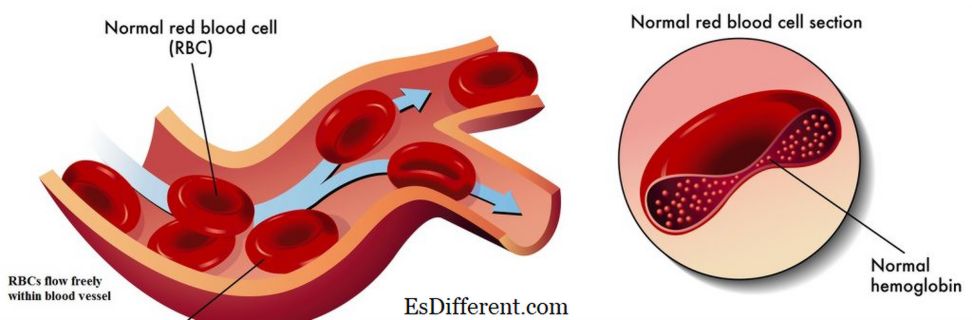
Figur 01: Normal Hemoglobin
Vad är Sickle Cell Hemoglobin?
Sicklecellanemi är ett blodtillstånd orsakat på grund av onormala hemoglobinproteiner som finns i de röda blodkropparna. Sicklecellshemoglobin är en typ av onormalt hemoglobin som finns i röda blodkroppar. De är också kända som hemoglobin S. De har segel eller halvmåneform. De produceras som ett resultat av sicklecell genmutation. Denna mutation ändrar en enda aminosyra i aminosyrasekvensen för normal hemoglobin beta-kedjepeptid. Sicklecellhemoglobin består också av två alfa och två beta-subenheter, precis som normalt hemoglobin. Det finns emellertid en enda aminosyraskillnad i beta-subenheter på grund av mutationen. I normalt hemoglobin är 6 th -positionen av aminosyrakedjan i beta-kedjor sammansatt av glutaminsyra. I sickle cellhemoglobin tas dock 6 th -position upp av en annan aminosyra som kallas valin. Även om det är en enda aminosyraskillnad är det orsaken till livshotande anemi-sjukdom som kallas sicklecellsjukdom.
När valin är placerad vid 6 th , orsakar beta-kedjan att bilda ett utsprång som passar till beta-kedjor av andra hemoglobinmolekyler. Dessa förbindelser gör sigelcellehemoglobin för att aggregera varandra utan att förbli i lösningen och transportera syre. Det tar en styv struktur, och slutligen bryts röda blodkroppar i förtid, vilket leder till anemi.

Figur 02: Sickle Cell Hemoglobin
Vad är skillnaden mellan normalt hemoglobin och Sickle Cell Hemoglobin?
Normalt hemoglobin är ett järnhaltigt protein i de röda blodkropparna, som transporterar syre och koldioxid genom blodet.
Blodcellshemoglobin är en typ av onormalt hemoglobin som orsakar agglutinering av seglformen röda blodkroppar i blodet. |
|
| Förkortning | Förkortning för det normala hemoglobinet är |
| HbA | |
| . Förkortning av sicklecellhemoglobin är HbS | . Struktur Strukturen av normalt hemoglobin består av två alfa-kedjor och två betakedjor. |
| Struktur av sicklecellhemoglobin består av två alfa-kedjor och två S-kedjor. | |
| Form | Normal hemoglobin är rund med ett smalt centrum. |
| Formen av den röda blodkroppen som innehåller sicklecellhemoglobin är halvmåne eller seglform. | |
| 6: e ställning av aminosyra | Den sjätte positionen i aminosyrakedjan av beta-globulinkedjan är glutaminsyra. |
| Den sjätte positionen upptas av valin i sicklecellhemoglobiner. | |
| Resultat | Normalt hemoglobin orsakar att röda blodkroppar flyter fritt inom blodkärlen. |
| Blodcellshemoglobin orsakar blockering av flödet av röda blodkroppar i kärlen. | |
| Sammanfattning - Normal Hemoglobin vs Sickle Cell Hemoglobin | Hemoglobin är det syretransporterande proteinet i röda blodkroppar. Den består av fyra subenheter av proteiner benämnda alfa- och betakedjor. Det är en järnhaltig molekyl som orsakar färgen och den runda formen av de röda blodkropparna. På grund av mutationer kan formen av de röda blodkropparna skilja sig. Det händer på grund av onormala hemoglobinmolekyler i de röda blodkropparna. Sockelcellshemoglobin är en sådan mutation. De förändrar formen av de röda blodkropparna från runda till seglform, vilket slutligen leder till för tidiga destruktioner av röda blodkroppar. Detta sjukdomstillstånd är känt som sicklecellanemi. Skillnaden mellan normalt hemoglobin och sicklecellhemoglobin är emellertid en enda aminosyraskillnad i beta-kedjan i hemoglobin. |
Referens:
1. Molecular Biology of Sickle Cell Anemia. N. p., n. d. Webb. 28 maj 2017..
2. "Sickle cell sjukdom - Genetics Home Reference. "U. S. National Library of Medicine. National Institute of Health, n. d. Webb. 28 maj 2017.
Image Courtesy:
1. "Risk-Factors-for-Sickle-Cell-Anemia (1) 2" Av Diana Grib - Egent arbete (CC BY-SA 4. 0) via Commons Wikimedia [Beskurna]



