Skillnad mellan normal och anomalös Zeeman-effekt | Normal vs Anomalous Zeeman Effect
Huvudskillnad - Normal vs Anomalous Zeeman Effect
I Holland fann de holländska fysikerna Pieter Zeeman splittringen av spektrallinjer emitterad av atomer i natriumklorid, när den hölls i ett starkt magnetfält. Den enklaste formen av detta fenomen infördes som vanlig Zeeman-effekt. Effekten förstods väl senare med införandet av teorin om elektron utvecklad av H. A. Lorentz. Den anomala Zeeman-effekten upptäcktes efter det med upptäckten av elektronens rotation 1925. Spaltningen av spektrallinjen emitterad av atomer placerade i ett magnetfält kallas i allmänhet Zeeman-effekten. I normal Zeeman-effekt delas linjen i tre linjer, medan splittringen i mer avvikande Zeeman-effekt är mer komplex. Detta är nyckelfaktorn mellan normal och anomalös Zeeman-effekt.
INNEHÅLL
1. Översikt och nyckelfaktor
2. Vad är Normal Zeeman Effect
3. Vad är Anomalous Zeeman Effect
4. Sida vid sida Jämförelse - Normal vs Anomalös Zeeman Effekt i Tabellform
5. Sammanfattning
Vad är Normal Zeeman Effect?
Normal Zeeman-effekt är fenomenet som förklarar splittringen av en spektrallinje i tre komponenter i ett magnetfält när det observeras i en riktning vinkelrätt mot det applicerade magnetfältet. Denna effekt förklaras av grunden för klassisk fysik. I normal Zeeman-effekt beaktas endast orbital vinkelmoment. Spinnvinkelmomentet, i detta fall, är noll. Normal Zeeman-effekt är endast giltig för övergångar mellan singletter i atomer. De element som ger den normala Zeeman-effekten inkluderar He, Zn, Cd, Hg, etc.
Vad är anomalös Zeeman-effekt?
Anomalös Zeeman-effekt är fenomenet som förklarar uppdelningen av en spektrallinje i fyra eller flera komponenter i ett magnetfält när den ses i en riktning vinkelrätt mot magnetfältet. Denna effekt är mer komplex till skillnad från normal Zeeman-effekt; Det kan således förklaras med hjälp av kvantmekanik. Atomerna med rotationsvinkelmomentet visar den anomala Zeeman-effekten. Na, Cr, etc., är elementära källor som visar denna effekt.
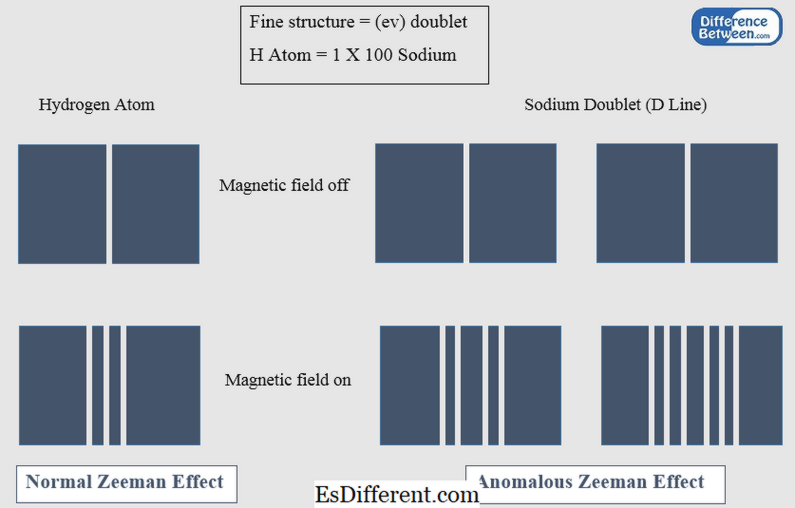
Figur 01: Normal och Anomalös Zeeman Effekt
Vad är skillnaden mellan Normal och Anomalös Zeeman Effect?
- diff Artikeln före bordet ->
Normal vs anomalös Zeeman-effekt |
|
| Spaltningen av en spektrallinje av en atom i tre linjer i ett magnetfält kallas normal Zeeman-effekt. | Spaltningen av en spektrallinje av en atom i fyra eller flera linjer i ett magnetfält kallas anomalös Zeeman-effekt. |
| Basis | |
| Detta förklaras av grunden för klassisk fysik. | Detta förstås med hjälp av kvantmekanik. |
| Magnetisk moment | |
| Magnetiskt moment beror på orbital vinkelmoment. | Magnetmomentet beror på både orbital och nonzero spin-vinkelmomentet |
| Elements | |
| Kalcium, koppar, zink och kadmium är några element som visar denna effekt. | Natrium och krom är två element som visar denna effekt. |
Sammanfattning - Normal vs Anomalous Zeeman Effect
Normal Zeeman-effekt och anomalös Zeeman-effekt är två fenomen som förklarar varför spektrala linjer av atomer delas upp i ett magnetfält. Zeeman-effekten introducerades först av Pieter Zeeman 1896. Den normala Zeeman-effekten beror på enbart orbital vinkelmoment som delade spektrallinjen i tre linjer. Den anomala Zeeman-effekten beror på ojämn spinnvinkelmoment, vilket skapar fyra eller flera spektrallinjer splittring. Därför kan man dra slutsatsen att anomalös Zeeman-effekt verkligen är en normal Zeeman-effekt med addition av spin-singulär momentum, bortsett från det orbitala vinkelmomentet. Således är det bara en liten skillnad mellan normal och anomalös Zeeman-effekt.
Hämta PDF-version av Normal vs Anomalous Zeeman Effect
Du kan hämta PDF-versionen av den här artikeln och använda den för offline-ändamål enligt citationsnotat. Var god ladda ner PDF-version här Skillnaden mellan Normal och Anomalous Zeeman Effect.
Referenser:
1. Aruldhas, G. Molekylär struktur och spektroskopi. New Delhi: PHI Learning, 2007. Skriv ut.
2. Bongaarts, Peter. Kvantteori: ett matematiskt tillvägagångssätt. Cham: Springer, 2014. Skriv ut.
3. Lipkowitz, Kenny B. och Donald B. Boyd. Recensioner i beräkningskemi. New York: Wiley-VCH, 2000. Skriv ut.


