Skillnad mellan isotonisk och hypertonisk | Isotonisk vs Hypertonisk
Huvudskillnad - Isotonisk vs Hypertonisk
Det är viktigt att förstå begreppet Tonicity innan man analyserar skillnaden mellan isoton och hyperton. Låt oss därför kort beskriva begreppet tonicitet och dess betydelse. Tonicitet är variansen i vattenkoncentration av två lösningar dividerat med ett semipermeabelt membran. Det kan också förklaras som den relativa vattenkoncentrationen av lösningar som bestämmer riktningen och mängden av diffusion av vatten tills det uppnår lika koncentrationer på båda sidor av membranet. Genom att identifiera toniciteten av lösningar kan vi bestämma i vilken riktning vattnet kommer att diffundera. Detta fenomen används vanligen när man illustrerar svaret på celler nedsänkt i en extern lösning. Det finns tre klassificeringar av tonicitet som en lösning kan ha i förhållande till en annan. De är hypertoniska, hypotoniska och isotoniska. nyckelförskjutningen mellan isoton och hypertonic är att den hypertona lösningen innehåller mer lösningsmedel än lösningsmedel medan lösningsmedlet och lösningsmedlet är lika fördelade i den isotoniska lösningen. Det är emellertid inte nödvändigt att memorera definitionen av hypertoniska och isotoniska lösningar om vi kan förstå skillnaden mellan isotoniska och hypertoniska lösningar.
Vad är Hypertonic?
Hyper är ett annat ord för ovan eller överdriven. Hypertoniska lösningar kommer att ha en högre koncentration av löst ämne (glukos eller salt) än cellen. Lösningar är de element som löses i ett lösningsmedel och bildar därigenom en lösning. I en hypertonisk lösning är koncentrationen av lösta ämnen större utanför cellen än inuti den. När en cell nedsänktes i en hypertonisk lösning kommer det att finnas ett osmotiskt skift och vattenmolekyler kommer att strömma ut ur cellen för att balansera koncentrationen av lösta ämnen och det kommer krympning i cellens storlek.
Vad är isotonisk?
Iso är ett annat ord för lika och tonic är för lösningens tonicitet. Isotoniska lösningar kommer att ha en liknande koncentration av lös substans än lösningen den jämförs med. I en isotonisk lösning är koncentrationen av lösta ämnen lika inom och utanför cellen som skapar en jämvikt inom miljön hos den cellulära organisationen. När en cell nedsänktes i en isotonisk lösning kommer det inte att finnas en osmotisk skift och vattenmolekyler diffunderar genom cellmembranet i båda riktningarna för att balansera koncentrationen av lösta ämnen.Denna process kommer inte att skapa svullnad eller krympning av cellen.

Vad är skillnaden mellan isoton och hypertonic?
Skillnaderna mellan hypertonisk och isotonisk kan klassificeras i följande kategorier.
Definition av Isotonisk och Hypertonisk
Hypertonisk: "Hyper" är känd som ovan eller överdriven + "tonic" är känd som något i linje med en lösning. Sålunda föreslår hypertonisk ökad tonicitet av lösningen.
Isotonisk: "iso" är känd som samma + "tonic" är känd som något i linje med en lösning. Sålunda föreslår isoton liknande likhet hos lösningen.
Egenskaper för Isoton och Hypertonic
Koncentration av lösningsmedel och lösning
Hypertonisk: Lösningen innehåller mer lösningsmedel än lösningsmedel.
Isotonisk: Lös och lösningsmedel i lösningen fördelas på lika sätt.
Exempel
Hypertonisk: Renat vatten, eftersom ingen / mindre lösningsmedel löses i det renade vattnet, och dess koncentration är mycket låg jämfört med den cellulära miljön.
Isotonisk: Salinlösning är en isotonisk blodplasma för människor
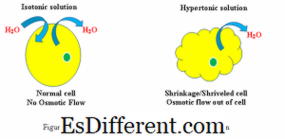
Cellrespons i hypertonisk och isotonisk lösning (Se figur 1)
Hypertonisk: När en biologisk cell är i en hypertonisk miljö, strömmar vatten över cellmembranet ur cellen, för att balansera koncentrationen av lösta ämnen i både cellen och miljön runt cellen. Som ett resultat kommer cellen att krympa som vatten lämnar cellen för att minska den högre koncentrationen av lösningsmedel i den yttre miljön.
Isotonisk: När en cell är i en isotonisk lösning, kommer det inte att skapa svullnad eller krympning av cellen.
Vattenkoncentrationsgradient
Hypertonisk: Vattenkoncentrationsgradienten kan observeras från insidan av cellen till den hypertoniska lösningen
Isotonisk: Vattenkoncentrationsgradienten existerar inte
Lös koncentrationsgradient < Hypertonisk:
Lös koncentrationsgradient ses från hypertonlösningen till insidan av cellen Isotonisk:
Lös koncentrationsgradient existerar inte. Osmotisk skift
Hypertonisk:
osmotisk skift existerar. Isotonisk:
osmotisk växling existerar inte Vattenförflyttning
Hypertonisk:
Vattenmolekyler rör sig eller diffunderar snabbt från insidan av cellen till yttre lösningsriktningar och sålunda kommer cellen att förlora vatten. Isotonisk:
Vattenmolekyler rör sig eller diffunderar i båda riktningarna, och graden av vattendiffusion är likartad i varje riktning. Således kommer cellen antingen att erhålla eller förlora vatten. Sportdrycker
Isotonisk:
En isotonisk dryck består av liknande koncentrationer av salt, sockerkarbohydrat och elektrolyter som i människokroppen. Isotonisk sportdryck föredras ofta som en oral rehydreringslösning. Det har vanligtvis 4-8 g kolhydrat per 100 ml. Hypertonisk:
Hypertonisk dryck innefattar högre koncentrationer av salt, sockerkolhydrat och elektrolyter som i människokroppen.Den har vanligen ca 8 g kolhydrat per 100 ml. En hypertonisk lösning används också vid osmoterapi för att hantera hjärnblödning. Hypertoniska sportdrycker är idealiska för dem som behöver mycket höga energinivåer. Sammanfattningsvis finns det tre former av lösningar som är baserade på koncentrationen av lösningsmedel och de är isotoniska, hypotoniska och hypertoniska. Koncentrationen av lösta ämnen är desamma både inom och utanför cellen i en isotonisk lösning. Koncentrationen av lösta ämnen är större inom cellen än den yttre miljön i en hypotonisk lösning medan den hypertoniska lösningen är en där koncentrationen av lösta ämnen är större utanför omgivningen än inuti cellen.
Referenser Mansoor, M.A., Beverly, J., och Sandmann. (2002). Applied Physical Pharmacy. McGraw-Hill Professional. s. 54-57. Voet, D., Judith, G.V. och Charlotte, W.P. (2001). Grundämnena för biokemi (rev. Ed). New York: Wiley. s. 30. Image Courtesy: "Osmotiskt tryck på blodceller diagram" av LadyofHats - gjorde det själv baserat på [1], [2], [3] och [4] … (Public Domain) via Wikimedia Commons




