Skillnad mellan joniska och kovalenta föreningar | Joniska vs kovalenta föreningar
Huvudskillnad - Joniska vs kovalenta föreningar
Många skillnader kan noteras mellan joniska och kovalenta föreningar baserade på deras makroskopiska egenskaper, såsom löslighet i vatten, elektrisk ledningsförmåga, smältpunkter och kokpunkter. Huvudskälet till dessa skillnader är skillnaden i deras bindningsmönster. Därför kan deras bindningsmönster betraktas som nyckelförskjutningen mellan joniska och kovalenta föreningar. (Skillnad mellan joniska och kovalenta bindningar) När jonbindningar bildas doneras elektron (er) av en metall och donerade elektroner accepteras av en icke-metall. De bildar en stark bindning på grund av den elektrostatiska attraktionen. Kovalenta bindningar bildas mellan två icke-metaller. Vid kovalent bindning delar två eller flera atomer elektroner för att tillfredsställa oktettregeln. I allmänhet är jonbindningar starkare än kovalenta bindningar. Detta leder till skillnaderna i deras fysikaliska egenskaper.
Vad är joniska föreningar?
Joniska bindningar bildas när två atomer har stor skillnad i sina elektronegativitetsvärden. I processen med bindningsbildning, får de mindre elektronegativa atomförlusterna elektron (er) och mer elektronegativ atom dessa elektroner. Följaktligen är resulterande arter motsatt laddade joner och de bildar ett bindning på grund av den starka elektrostatiska attraktionen.
Joniska bindningar bildas mellan metaller och icke-metaller. Vanligtvis har metaller inte många valenselektroner i yttersta skalet; emellertid har icke-metaller närmare åtta elektroner i valensskalet. Därför tenderar icke-metaller att acceptera elektroner för att tillfredsställa oktettregeln.
Exempel på jonisk förening är Na + + Cl - à NaCl
Natrium (metall) har bara en valenselektron och Klor (icke-metall) sju valenselektroner.

Vad är kovalenta föreningar?
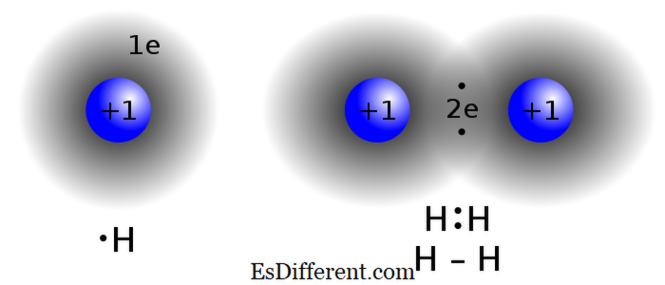
Kovalenta föreningar bildas genom att dela elektroner mellan två eller flera atomer för att tillfredsställa "oktettregeln". Denna bindningstyp finns vanligen i icke-metallföreningar, atomer av samma förening eller närliggande element i det periodiska bordet. Två atomer som har nästan samma elektronegativitetsvärden utbyter inte (donera / ta emot) elektroner från deras valensskal. I stället delar de elektroner för att uppnå oktettkonfiguration.
Exempel på kovalenta föreningar är metan (CH 4 ), kolmonoxid (CO), jodmonobromid (IBr) kovalent bindning
Vad är skillnaden mellan jonisk och kovalent Föreningar?
Definition av joniska föreningar och kovalenta föreningar
Jonisk förening:
Jonisk förening är en kemisk förening av katjoner och anjoner som hålls ihop av jonbindningar i en gitterstruktur. Kovalent förening:
Kovalent förening är en kemisk bindning som bildas genom delning av en eller flera elektroner, särskilt par av elektroner, mellan atomer. Egenskaper av joniska och kovalenta föreningar
Fysiska egenskaper
Joniska föreningar:
Alla joniska föreningar existerar som fastämnen vid rumstemperatur.
Joniska föreningar har en stabil kristallstruktur. Därför har de högre smältpunkter och kokpunkter. Åtgärdskrafterna mellan positiva och negativa joner är mycket starka.
- diff. Artikel Middle före tabell ->
Jonisk förening| Utseende | Smältpunkt | NaCl - Natriumklorid |
| Vitt kristallint fastämne | 801 ° C | KCl - Kaliumklorid |
| Vit eller färglös kristallin kristall | 770 ° C | MgCl |
| 2 - Magnesiumklorid Vitt eller färglöst kristallint fastämne | 1412 ° C | Kovalenta föreningar: Kovalenta föreningar finns i alla tre former; som fasta ämnen, vätskor och gaser vid rumstemperatur. |
Deras smält- och kokpunkter är relativt låga jämfört med de joniska föreningarna.
Kovalent förening
Utseende
| Smältpunkt | HCl-väteklorid | En färglös gas |
| -114. 2 ° C | CH 4 | -Metan |
| En färglös gas -182 ° C CCl | 4 | - Koltetraklorid |
| En färglös vätska < -23 ° C Ledningsförmåga Joniska föreningar: | Fasta joniska föreningar har inte fria elektroner; därför leder de inte elektricitet i fast form. Men när joniska föreningar löses i vatten, bildar de en lösning som leder elektricitet. Med andra ord är vattenhaltiga lösningar av jonföreningar bra elektriska ledare. | Kovalenta föreningar: |
Varken rena kovalenta föreningar eller upplösta former i vatten leder inte elektricitet. Därför är kovalenta föreningar dåliga elektriska ledare i alla faser.
Löslighet Joniska föreningar:
De flesta jonföreningarna är lösliga i vatten, men de är olösliga i icke-polära lösningsmedel. Kovalenta föreningar:
De flesta av de kovalenta föreningarna är lösliga i icke-polära lösningsmedel, men inte i vatten.
Hårdhet Joniska föreningar:
Joniska fasta ämnen är hårdare och spröda föreningar. Kovalenta föreningar:
Generellt är kovalenta föreningar mjukare än joniska fasta ämnen.
Image Courtesy: "Kovalent bondväte" av Jacek FH - eget arbete. (CC BY-SA 3. 0) via Commons "IonicBondingRH11" av Rhannosh - eget arbete. (CC BY-SA 3. 0) via Wikimedia Commons




