Skillnad mellan hydrolys och kondensation
Hydrolys vs kondensation
Kondensation och hydrolys är två typer av kemiska reaktioner, vilka är involverade i bindningsbildning och bindningsbrott. Kondensation är bakom hydrolysen. Dessa två typer av reaktioner finns vanligen inom biologiska system, och vi använder också dessa reaktioner för att erhålla många kommersiellt viktiga produkter.
Kondensation
Kondensationsreaktioner är en typ av kemisk reaktion där små molekyler träffas för att bilda en stor enkel molekyl. Reaktionen sker inom två funktionella grupper i molekylerna. Ett annat karakteristiskt kännetecken för en kondensationsreaktion är att en liten molekyl förloras under reaktionen. Denna molekyl kan vara vatten, väteklorid, ättiksyra etc. Om den förlorade molekylen är vatten är dessa typer av kondensationsreaktioner kända som uttorkningsreaktioner. Eftersom reaktantmolekylerna är mindre och produktmolekylen är mycket stor, kommer densiteten av produkterna alltid att vara högre än reaktionerna i kondensationsreaktioner. Kondensationsreaktioner sker på flera sätt. Till exempel kan vi i stor utsträckning dela dessa i två typer som intermolekylära kondensationsreaktioner och intra-molekylära kondensationsreaktioner. Om de två funktionella grupperna är bosatta i samma molekyl, är de kända som intra-molekylära kondensationer. Till exempel har glukos en linjär struktur enligt följande.
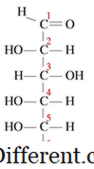
I en lösning ligger majoriteten av molekylerna i en cyklisk struktur. När en cyklisk struktur bildas omvandlas -OH på kol 5 till eterbindningen för att stänga ringen med kol 1. Detta bildar en sex-medlems hemiacetalringstruktur. Under denna intra-molekylära kondensationsreaktion avstötas en vattenmolekyl, och en eterbindning bildas. Intermolekylära reaktioner producerar många användbara och gemensamma produkter. Under detta sker reaktionen mellan funktionella grupper av två separata molekyler. När man till exempel bildar en makromolekyl som protein kondenseras aminosyror. En vattenmolekyl frisätts, och en amidbindning bildas, vilken är känd som en peptidbindning. När två aminosyror är bundna samman bildas en dipeptid, och när många aminosyror är förenade kallas den en polypeptid. DNA och RNA är också två makromolekyler bildade som ett resultat av kondensationsreaktioner mellan nukleotider. Kondensationsreaktioner producerar mycket stora molekyler och ibland är molekylerna inte så stora. Till exempel: i förestringsreaktionen mellan en alkohol och en karboxylsyra bildas en liten estermolekyl om den bildas. Kondensation är viktig vid polymerbildning. Polymerer är stora molekyler, som har samma strukturella enhet som upprepas om och om igen.De upprepande enheterna kallas monomerer. Dessa monomerer binds till varandra med kovalenta bindningar för att bilda en polymer.
Hydrolys
Detta är en reaktion där en kemisk bindning bryts med en vattenmolekyl. Under denna reaktion delas en vattenmolekyl upp i en proton och en hydroxidjon. Och sedan läggs dessa två joner till de två delarna av molekylen där bindningen är bruten. Till exempel är följande en ester. Esterbindningen är mellan -CO och -O.

Vid hydrolysen tillför protonen från vattnet till -O sidan, och hydroxidjonen tillför-CO-sidan. Därför kommer som en följd av hydrolysen att bilda en alkohol och en karboxylsyra som var reaktanterna när de bildade estern.
|
Vad är skillnaden mellan hydrolys och kondensation? • Hydrolys är motsatt av kondens. • Kondensationsreaktioner gör kemiska bindningar medan hydrolysen bryter mot kemiska bindningar. • Polymerer tillverkas genom kondensationsreaktioner, och de bryts av hydrolysreaktioner. • Vid kondensationsreaktioner kan vattenmolekyl frigöras. I hydrolysreaktionerna införlivas vattenmolekyl i molekylen. |


