Skillnad mellan enzym och koenzym | Enzym vs Coenzym
Huvudskillnad - Enzym vs Koenzym
Kemiska reaktioner omvandlar en eller flera substrat till produkter. Dessa reaktioner katalyseras av speciella proteiner som kallas enzymer. Enzymer fungerar som en katalysator för de flesta reaktioner utan att konsumeras. Enzymer är gjorda av aminosyror och har unika aminosyrasekvenser som består av 20 olika aminosyror. Enzymer stöds av små icke-proteiniska organiska molekyler som kallas kofaktorer. Coenzymer är en typ av koaktorer som hjälper enzymer att utföra katalys. Den viktigaste skillnaden mellan enzym och koenzym är att enzymet är ett protein som katalyserar de biokemiska reaktionerna medan koenzym är en icke-protein organisk molekyl som hjälper enzymer att aktivera och katalysera de kemiska reaktionerna. Enzymer är makromolekyler medan koenzymer är små molekyler.
INNEHÅLL
1. Översikt och nyckelfaktor
2. Vad är ett enzym
3. Vad är ett koenzym
4. Jämförelse vid sida vid sida - enzym mot koenzym
5. Sammanfattning
Vad är ett enzym?
Enzymer är biologiska katalysatorer av levande celler. De är proteiner som består av hundratals till miljontals aminosyror fästa tillsammans som pärlor på en sträng. Varje enzym har en unik aminosyrasekvens och bestäms av en specifik gen. Enzymer accelererar nästan alla biokemiska reaktioner i levande organismer. Enzymer påverkar endast reaktionshastigheten och deras närvaro är väsentligt för att initiera den kemiska omvandlingen eftersom reaktionsenergin för reaktionen sänks av enzymer. Enzymer ändrar reaktionshastigheten utan att konsumeras eller utan att ändra den kemiska strukturen. Samma enzym kan katalysera omvandlingen av allt fler substrat till produkter genom att visa förmågan att katalysera samma reaktion om och om igen.
Enzymer är mycket specifika. Ett särskilt enzym binder med ett specifikt substrat och katalyserar en specifik reaktion. Specifikiteten hos enzymet orsakas av enzymprofilen. Varje enzym har en aktiv plats med en specifik form och funktionella grupper för specifik bindning. Endast det specifika substratet kommer att matcha formen på den aktiva platsen och binda med den. Specificiteten för enzym-substratbindningen kan förklaras av två hypoteser som heter lås- och nyckelhypotes och inducerad passformshypotes. Lås- och nyckelhypotesen anger att matchningen mellan enzym och substrat är specifik som lås och nyckel. Inducerad passformshypotes berättar att formen på den aktiva platsen kan förändras för att passa formen på det specifika substratet liknar handskar som passar en hand.
Enzymatiska reaktioner påverkas av flera faktorer som pH, temperatur etc. Varje enzym har ett optimalt temperaturvärde och pH-värde för att fungera effektivt. Enzymer interagerar också med icke-proteinkofaktorer, såsom protetiska grupper, koenzymer, aktivatorer etc. för att katalysera biokemiska reaktioner. Enzymer kan förstöras vid hög temperatur eller med hög surhet eller alkalitet eftersom de är proteiner.

Figur 01: Inducerad passform av enzymaktivitet.
Vad är ett koenzym?
Kemiska reaktioner stöds av icke-proteinmolekyler som kallas kofaktorer. Cofaktorer hjälper enzymer att katalysera kemiska reaktioner. Det finns olika typer av kofaktorer och koenzymer är en typ bland dem. Coenzym är en organisk molekyl som kombinerar med ett enzym-substratkomplex och hjälper reaktionens katalyseprocess. De är också kända som hjälparmolekyler . De består av vitaminer eller härrör från vitaminer. Därför bör dieter innehålla vitaminer som ger väsentliga koenzymer för de biokemiska reaktionerna.
Koenzymer kan binda med enzymets aktiva ställning. De binder löst med enzymet och hjälper den kemiska reaktionen genom att tillhandahålla funktionella grupper som behövs för reaktionen eller genom att ändra enzymkonstruktionens konformation. Därför blir bindningen av substratet lätt, och reaktionen driver mot produkterna. Vissa koenzymer verkar som sekundära substrat och blir kemiskt förändrade i slutet av reaktionen, till skillnad från enzymer.
Koenzymer kan inte katalysera en kemisk reaktion utan ett enzym. De hjälper enzymer att bli aktiva och utföra sina funktioner. När koenzymet binder med apoenzymen blir enzymet en aktiv form av enzymet som kallas holoenzym och initierar reaktionen.
Exempel på koenzymer är adenosintrifosfat (ATP), Nikotinamid-adenin-dinukleotid (NAD), Flavin-adenindinukleotid (FAD), Coenzyme A, vitaminer Bl, B2 och B6, etc.
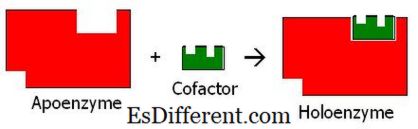
Figur 02: Cofaktorbindning med en apoenzyme
Vad är skillnaden mellan enzym och koenzym?
- diff Artikel Middle before Table ->
Enzym vs Coenzym |
|
| Enzymer är biologiska katalysatorer som accelererar kemiska reaktioner. | Koenzymer är organiska molekyler som hjälper enzymer att katalysera de kemiska reaktionerna. |
| Molekylär typ | |
| Alla enzymer är proteiner. | Coenzymer är icke-proteiner. |
| Förändring på grund av reaktioner | |
| Enzymer förändras inte på grund av kemisk reaktion. | Koenzymer förändras kemiskt som ett resultat av reaktionen. |
| Specificitet | |
| Enzymer är specifika. | Koenzymer är inte specifika. |
| Storlek | |
| Enzymer är större molekyler. | Coenzymer är mindre molekyler. |
| Exempel | |
| Amylas, proteinas och kinas är exempel på enzymer. | NAD, ATP, koenzym A och FAD är exempel på koenzymer. |
Sammanfattning - Enzym vs Koenzym
Enzymer katalyserar kemiska reaktioner. Coenzymer hjälper enzymer att katalysera reaktionen genom att aktivera enzymer och tillhandahålla funktionella grupper.Enzymer är proteiner som består av aminosyror. Coenzymer är inte proteiner. De härrör huvudsakligen från vitaminer. Detta är skillnaderna mellan enzymer och koenzymer.
Referens:
1. ”Enzymer. "RSC. N. p., n. d. Webb. 15 maj 2017..
2. "Strukturell biokemi / enzym / koenzymer. "Structural Biochemistry / Enzyme / Coenzymes - Wikibooks, öppna böcker för en öppen värld. N. p., n. d. Webb. 15 maj 2017..
Image Courtesy:
1. "Induced fit diagram" Av Skapat av TimVickers, vektoriserad av Fvasconcellos - Tillhandahålls av TimVickers (Public Domain) via Commons Wikimedia
2. "Enzymes" Av Moniquepena - Egent arbete (Public Domain) via Commons Wikimedia



