Skillnad mellan ammoniumnitrat och urea
Ammoniumnitrat vs urea
Föreningar som innehåller kväve används vanligen som gödningsmedel eftersom kväve är ett av de mycket väsentliga elementen för växttillväxt och utveckling. Ammoniumnitrat och urea är sådana kväveinnehållande fastämnen.
Ammoniumnitrat
Ammoniumnitrat har den kemiska formeln av NH 4 NO 3 . Detta är nitrat av ammoniak, och den har följande struktur.

Vid rumstemperatur och standardtryck finns ammoniumnitrat som ett luktfritt, vitt kristallint fastämne. Detta är ett surt salt med ett pH av ca 5. 4. Den molära massan är 80,052 g / mol. Smältpunkten för ammoniumnitrat är ca 170 ° C och sönderdelas vid uppvärmning till ca 210 o C. Ammoniumnitrat används huvudsakligen för jordbruksändamål. Den är rik på kväve, så det används som gödningsmedel, för att ge kväve till växter. Eftersom den direkta kontakten med kemikalier inte är farlig och giftigheten är mindre, är det fördelaktigt att använda som gödningsmedel. Dessutom orsakar uppvärmning eller tändning ammoniumnitrat att explodera. Därför används den som ett oxidationsmedel i sprängämnen. På grund av denna explosiva natur, bör vi vara extra försiktig när vi lagrar ammoniumnitrat. Ammoniumnitrat är stabil, men när det är i smält tillstånd är risken för explosion högre. Risken ökar om det kommer i kontakt med oxiderbara material som olja, diesel, papper, trasa eller halm. Produktion av ammoniumnitrat är en enkel kemisk reaktion. När salpetersyra reageras med ammoniakvätska, produceras ammoniumnitrat i lösningsformen. Industriellt koncentrerad salpetersyra och ammoniakgas används för produktion. Eftersom detta är en mycket exoterm och våldsam reaktion är det utmanande att producera det i stor skala. Som ett salt är ammoniumnitrat mycket lösligt i vatten. Därför kan den, när den används som gödningsmedel, tvättas och ackumuleras i vattenkroppar. Detta kan vara ett dödligt tillstånd för vattenlevande liv.
Urea Urea har molekylformeln för CO (NH
2 ) 2 och följande struktur. Det är en karbamid med funktionell gruppen C = O. Två NH
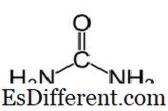
2 grupper är bundna till karbonylkolet från två sidor. Urea produceras naturligt i däggdjur i kvävemetabolism. Detta kallas ureacykeln, och oxidation av ammoniak eller aminosyror ger urea inne i våra kroppar. Det mesta av urea utsöndras genom njurar med urin medan vissa utsöndras med svett. Den höga vattenlösligheten hos urea är till hjälp när den utsöndras från kroppen. Urea är ett färglöst, luktfritt fast ämne och det är giftfritt. Annat än att vara en metabolisk produkt, är dess huvudsakliga användning att producera gödselmedel.Urea är ett av de vanligaste kväveavgivande gödselmedlet, och det har en hög kvävehalt jämfört med andra fasta kvävehaltiga gödningsmedel. I jord omvandlas urea till ammoniak och koldioxid. Denna ammoniak kan omvandlas till nitrit genom jordbakterier. Vidare används urea för att producera sprängämnen som urea nitrat. Det används också som råmaterial för att tillverka kemikalier som plast och lim.



